2-己基咪唑作为铜的盐酸酸洗缓蚀剂作用机理的研究
1 实验部分
1.1 实验条件及方法
用AR 级36 %~38 %盐酸加去离子水配成5 % 盐酸酸洗液,酸洗介质为5 %盐酸或不同浓度缓蚀 剂溶于5 %盐酸。缓蚀剂用自制的22He IM ,可直接 溶于盐酸酸洗液。实验对象为铜试片。
实验采用失重法。实验前先将铜片打磨至镜面光亮,去脂、水洗、干燥、称重,然后将平行挂片挂在装有酸洗液的玻璃瓶中,再浸到恒温水浴中。经18h腐蚀后,取出试片,先除去铜表面的腐蚀产物然后 用稀NaOH溶液中和,最后用自来水清洗、干燥、称重。每组数据取三次平行测定的平均值。
1.2 实验内容
分别在15 、20 、25 、30 、35 ℃下用含不同浓度22 He IM 的5 %盐酸酸洗液进行实验,从中得出温度和 缓蚀剂浓度对缓蚀率的影响,并进一步探讨缓蚀剂 的作用机理。其中缓蚀率η的定义为:

其中, v 和v0 分别为加缓蚀剂和不加缓蚀剂时单位 时间、单位面积铜片的失重量,在腐蚀时间和铜片厚 度都一定的情况下,可以分别用各自的失重率z 来 代替。z =Δw/ w0 ,Δw 和w0 分别代表腐蚀过程的 失重量和铜片的原重。
2 结果与讨论
2.1 22HeIM的浓度对缓蚀率的影响
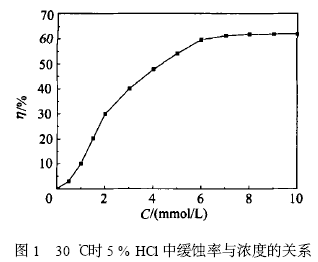
30 ℃时5 %盐酸中22He IM 的浓度与对铜的缓 蚀率的关系,如图1 所示。
由图1 可知,缓蚀率η随着22He IM 浓度C 的 提高而提高。在015 mmol/ L 到1 mmol/ L 的低浓度 范围内缓蚀率随浓度的变化而变化得较为缓慢,主 要是因为低浓度时22He IM 在铜表面的吸附量有限。在1 mmol/ L 到6 mmol/ L 范围内,缓蚀率η的 变化非常显著, 说明浓度在此范围内变化时, 22 He IM 在铜表面所成膜的覆盖度变化比较明显。当 22He IM 的浓度大于6mmol/ L 时,缓蚀率基本不变, 说明在6 mmol/ L 时,22He IM 在铜表面已基本达到 饱和吸附。所以本文选择6 mmol/ L 为最佳添加浓 度。30 ℃时加6 mmol/ L 22He IM 的酸洗液中对铜 的缓蚀率为591693 %。
2.2 22HeIM的缓蚀作用机理
2.2.1 2-HeIM在铜表面的吸附等温式及分子间作用力的探讨Frumkin吸附等温式考虑了吸附分 子间的侧向作用力,已经有人用此等温式在研究缓蚀剂的作用机理,并取得了令人满意的结果。 选择此等温式来研究30 ℃下,5 %盐酸中22HeIM浓度从2mmol/L变到6mmol/L时的吸附情况。Frumkin吸附等温式为:
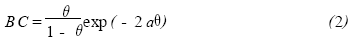
式中 C 为被吸附物的摩尔浓度, B 为吸附平衡常 数,θ为表面覆盖度, a 为被吸附粒子间的作用力常 数,当0 < a < 2 时为引力, a < 0 时为斥力。
22He IM 属吸附型缓蚀剂, 表面覆盖度θ等于 缓蚀率η ,将(2) 式取对数,整理得:
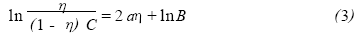
对ln[η/ (1 - η) C]~η线性回归得缓蚀率η与缓蚀 剂浓度的关系,如图2 所示。
由回归方程求得, a = 01256 6 ,lnB = 51227 4 。 因为0 < a < 2 ,所以浓度在2 mmol/ L 到6 mmol/ L 范围内,22He IM 在铜表面吸附时分子间的作用力 整体表现为引力。当22He IM 的浓度大于6 mmol/ L 时,22He IM 在铜表面的覆盖度增大,从铺在铜表面的咪唑环上伸出的—C6H13取代基较多,使得空间效 应引起的分子间排斥力超过了库仑力和范德华力等 引力,分子间整体表现为斥力,从而使22He IM 在铜 表面达到饱和吸附,缓蚀率趋于稳定值。

2.2.2 22He IM 在铜表面吸附时的热效应 温度 对吸附平衡常数的影响可用式(4)来表示:

在21211 中得到了30 ℃时吸附反应的平衡常 数,用同样的方法得到了15 、20 、25 、35 ℃时的吸附 平衡常数。对ln B ~1/ T ( T 为绝对温度) 线性回 归,如图3 所示。
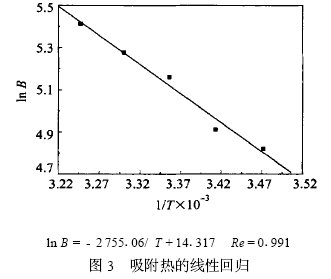
由回归方程的斜率得出ΔH = 22190 kJ/mol 说 明反应是吸热反应,而且吸附热达到了化学吸附的 数量级,说明是化学吸附。这从表1列出的铜片在 22HeIM浓度为6mmol/L的酸洗液中不同温度下 的缓蚀率可以看出,随温度的上升缓蚀率呈上升趋势,这也说明了吸附为吸热反应。
